Dr. Alfonso Rodríguez Jaramillo*, Dr. Rubén Rodríguez Pérez **
INTRODUCCIÓN
La hipoacusia es el déficit sensorial más frecuente en niños, siendo la hipoacusia sensorio neural la forma más común de déficit auditivo congénito (1,2). Se estima en México que alrededor de 10 millones de personas tienen algún tipo de problema auditivo (OMS), de las cuales entre 200,000 y 400,000 presentan sordera total. Cada año, nacen entre 2,000 y 6,000 niños con sordera congénita. Estas cifras manifiestan que los trastornos auditivos constituyen un importante problema de salud pública en nuestro país. (12)
La incidencia se estima en 1:1.000 recién nacidos (1-2) para hipoacusias severas a profundas mayores a 50 dB y sobre 4:1.000 RN si se incluyen las formas leves a moderadas. Por lo anterior, se puede decir que la Hipoacusia sensorio neural en niños es relativamente frecuente y puede ser comparada con la incidencia del síndrome de Down (1:600-800 RN), fisura labio-palatina (1:750 RN) y fibrosis quística (1:3,500 RN blancos). (2)
ANTECEDENTES
La hipoacusia es la pérdida parcial de la capacidad auditiva. La pérdida auditiva se puede catalogar como leve, moderada, grave o profunda en uno o ambos oídos. Las personas con hipoacusia habitualmente utilizan el canal auditivo y el lenguaje oral para comunicarse, y pueden escuchar el llanto de un bebé o el ladrido de un perro.
Habitualmente dentro del manejo estos pacientes se considera el uso de auxiliares auditivos o en el caso de las pérdidas profundas de un implante coclear (6). Es importante no perder de vista que la hipoacusia no afecta el rendimiento intelectual de una persona. Se ha observado una disminución de la hipoacusia por causas infecciosas y ototoxicidad derivado de la optimización de los cuidados pediátricos y neonatales, especialmente en el manejo de unidades de cuidados intensivos neonatales y por la vacunación para rubéola y Haemophilus influenzae B.
Dentro de las causas conocidas de Hipoacusia sensorio neural se encuentran las de origen genético que pueden a su vez, ser divididas en sindrómicas y no sindrómicas. Es por ello que las causas genéticas serían responsables más del 50% de las hipoacusias congénitas severas a profundas.(5)
De manera particular, se estima que en México tres de cada 1,000 recién nacidos presentará discapacidad por hipoacusia, si esta anormalidad no se detecta y atiende con oportunidad.
LA IMPORTANCIA DE LA IDENTIFICACIÓN TEMPRANA DE PROBLEMAS DE HIPOACUSIA Y SORDERA RADICA EN EL HECHO IRREFUTABLE DE QUE UN NIÑO QUE NO OYE, NO DESARROLLA SU LENGUAJE ORAL y le será prácticamente imposible aprender a leer y a escribir. El lenguaje que haya logrado desarrollar un niño sordo a los cuatro o cinco años de edad, será el lenguaje con el que se pueda comunicar en adelante y le permitirán incorporarse a la sociedad en la vida futura. (12)
Para estudiar la pérdida de audición es necesario caracterizarla, así podemos clasificar las hipoacusias de formas tales como (3)
MATERIAL Y MÉTODOS
En un estudio prospectivo, de corte transversal, realizado en la unidad de evaluación acústica del Centro Médico Londres en Chetumal, Quintana Roo, México, en el que se incluyeron a estudio mediante Tamizaje Auditivo 100 niños, como parte de la evaluación integral de la audición, desde el 1 de enero del 2011 hasta el 10 de febrero del 2012.
Los niños fueron evaluados tomando en cuenta:
Los niños fueron evaluados con equipo interacoustics con la plataforma Eclipse que sirve para medir potenciales evocados y otoemisiones acústicas. Para todos los niños se realizó evaluación con protocolo de productos de distorsión (1000 a 12000 Hz) para ambos oídos y otoemisiones evocadas transitorias (500 a 4000 Hz) de ambos oídos. El equipo lleva a cabo las pruebas a partir de una unidad de hardware de alto rendimiento conectada a una PC. Los resultados se almacenan en una base de datos llamada OtoAcess TM desde donde pueden imprimirse o transferirse a través de Internet.
Se definió la Hipoacusia utilizando la siguiente escala: (3)
Hipoacusia Leve de 26 a 40 dB Hipoacusia Moderada de 41 a 55 dB
Hipoacusia Moderada/Grave de 56 a 70 dB Hipoacusia Grave de 71 a 90 dB
Hipoacusia Severa/Profunda 91 dB o más
RESULTADOS
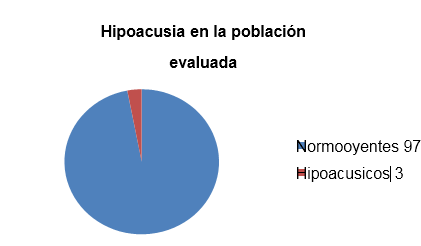
Durante el período comprendido del 1 enero del 2011 al 10 de febrero del 2012 se evaluaron 100 niños con un total de 200 oídos explorados y edades comprendidas desde el mes de edad hasta los 7 años en 1 caso, con una edad media de 4 meses ± 2.2 meses. De los 100 casos evaluados solamente el 2% se encontraron alteraciones congénitas no relacionadas a la hipoacusia siendo 1 el Síndrome de acondroplasia, documentado clínica y genéticamente y en el otro un caso de Síndrome de hipogammaglobulinemia tipo Bruton documentado inmunológicamente. Estos dos pacientes fueron negativos al estudio de hipoacusia.
La historia perinatal de las madres de los niños evaluados no demostró datos significativos en cuanto a factores de riesgo de lesión otoneurológica documentada, como exposición a amikacina u ototóxicos, hiperbilirrubinemia neonatal, e hipoxia al nacer.
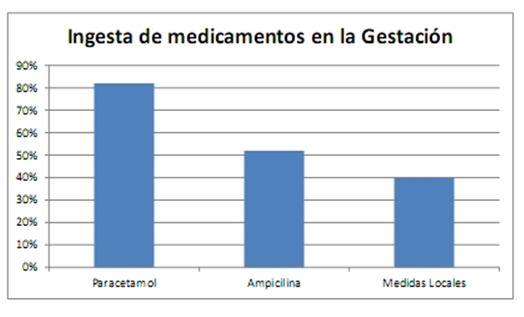
La ingesta de medicamentos durante el embarazo en la encuesta solicitada a las madres previo a la evaluación fue exclusivamente en el 82% de los casos de paracetamol, 52% de los casos para ampicilina y en el 40% de los casos algún tipo de óvulo vaginal con medidas locales de higiene.

De los 200 oídos evaluados se encontraron únicamente 4 casos de niños con hipoacusia: el primero de ellos reportó Hipoacusia Leve con Promedio de Tonos Audibles de 35 dB, con una hipoacusia conductiva de oído medio bilateral, secundaria a un cuadro de infección de vías respiratorias que remitió favorablemente al manejo médico con antiinflamatorio y antimicrobiano, por lo que fue descartado como diagnóstico definitivo de hipoacusia; 2 casos de hipoacusia media a grave con promedio de Tonos Audibles (PTA) de 65 dB , y finalmente un caso de hipoacusia grave con PTA de 72 dB en 1 caso, estos últimos 3 clasificados como hipoacusia sensorio neural. En los 3 casos de Hipoacusia Sensorio Neural no hubo historia familiar ni genética de hipoacusia, ni algún familiar relacionado con la pérdida auditiva. En el caso del niño con Hipoacusia conductiva se realizó una evaluación posterior al mes de tratamiento médico encontrando que la Hipoacusia había remitido, y fue catalogada como transitoria ya que el estudio posterior confirmó los niveles normales de audición. En el caso de los otros 3 niños evaluados 1 de ellos se encuentra con manejo de amplificación Auditiva con Auxiliares Digitales Widex TM Aikia A-19, otro caso más con auxiliares Widex TM, Bravo B12 y uno más con auxiliares de la marca Blauton TM Plus XT.
El caso del niño que utiliza los Auxiliares Aikia A-19, se encuentra con PTA de 28 dB, con la tecnología de amplificación, el caso del niño que utiliza los auxiliares Bravo B12 , se encuentra con PTA de 25 dB, con la tecnología de amplificación y finalmente el caso del niño que utiliza los Auxiliares Blauton Plus XT, se encuentra con PTA de 35 dB, con la tecnología de amplificación.
Actualmente todos ellos se encuentra en manejo con la Metodología Audioverbal para lograr incorporarse a las actividades escolares en escuela de normooyentes.
DISCUSIÓN
Para muchos médicos está pendiente resolver cuál es la evaluación diagnóstica más apropiada en niños con hipoacusia sensorio neural, considerando que constituyen un grupo sustancial de la población y que existe un número importante que no es diagnosticado, principalmente si no está implementado el tamizaje universal.
El diagnóstico etiológico de las hipoacusias congénitas es un frecuente desafío para los médicos (4). Se acepta que una completa historia clínica, un buen examen físico y una evaluación audiológica son herramientas suficientes para diagnosticar la causa de la hipoacusia. Muchos síndromes asociados con hipoacusia sensorio neural son diagnosticados mediante dichos estudios, sin embargo, solicitar un estudio completo es aún controversial debido a su rendimiento(5). Por lo tanto, las interrogantes del clínico apuntan a la necesidad de solicitar un amplio estudio de laboratorio e imágenes, junto con la opinión de variados especialistas encareciendo, retrasando y, de todos modos, dificultando llegar a un diagnóstico definitivo. (5)
Los test moleculares genéticos constituyen una nueva técnica que promete mejorar el diagnóstico de hipoacusia sensorio neural en niños, cuyo alcance hasta ahora visualizamos tan sólo parcialmente.
El estudio genético en hipoacusia ayudaría en un gran número de pacientes que están dentro del grupo de los que actualmente no son diagnosticados etiológicamente. Esto permitiría aclarar el pronóstico y naturaleza de la hipoacusia para lograr un mejor tratamiento pudiendo, tal vez a futuro, ser incluido en el tamizaje universal auditivo infantil. Además, podría solucionar en parte el creciente problema que ha traído el tamizaje auditivo para los médicos, al diagnosticar en forma cada vez más precoz hipoacusias en niños, respondiendo de mejor forma las interrogantes de padres y familiares sobre las causales de esta condición.(6,7)
Debido a los cientos de mutaciones y docenas de genes asociados con hipoacusia, la identificación de la mutación 35delG en el gen GJB2 en la población ha permitido la creación de un buen estudio genético de la audición. Una de las mayores ventajas del estudio genético de la audición, que examina la mutación 35delG en GJB2 es que permite acelerar el diagnóstico etiológico de la hipoacusia y limita mayores exámenes. El objetivo a futuro sería estudiar a los niños con un fenotipo de presentación limitado, esto es, los niños con hipoacusia sensorio neural que no son sindromáticos y que ocupan la mayoría de casos de hipoacusia detectados, como en las hipoacusia sensorio neurales bilaterales severas a profundas, que es la presentación más frecuente de la mutación 35delG. Esta, al ser identificada, evitaría otros exámenes (6). Aunque es cierto que la presentación fenotípica es ampliamente variable, existe una tendencia muy fuerte hacia las hipoacusias sensorio neurales severas a profundas.
Hasta el momento, la incidencia de niños identificados con una mutación GJB2 teniendo otra enfermedad concurrente es bajísima (8). Lo cual nos llevaría a deducir que en pacientes con hipoacusias moderadas a severas en el que los pacientes no tienen otra patología sindrómica asociada, ni familiares con historia de pérdida auditiva, esto es, hijos de padres y familiares sanos, con hipoacusia sensorio neural, la mutación del gen GJB2 podría por sí misma, ser la causa genética primaria de la hipoacusia.
Sin embargo, predecir exactamente el curso de la hipoacusia o de las distintas terapias puede ser aún precoz en el desarrollo de las técnicas genéticas. El estudio entonces serviría para tener el diagnóstico etiológico de la hipoacusia, pero no para predecir la evolución o curso del tratamiento. Es necesaria más información para responder esas interrogantes.
Aún así, para las familias que buscan las razones detrás de la hipoacusia de su hijo, estos test proveen de información muy valiosa y, probablemente, abren una nueva ventana para el tratamiento. Siendo esta mutación una causa común de hipoacusia en candidatos a implante coclear, es importante para el pronóstico de la rehabilitación saber que, aunque la conexina 26 existe en otros tejidos, no se ha encontrado otras anomalías neurológicas o cognitivas asociadas a la mutación 35delG (4-7-8). Se ha demostrado en múltiples publicaciones el excelente pronóstico de los niños con esta mutación para implante coclear, ya sea en igual proporción a los no portadores o incluso con mejores resultados, lo que se debería por ser un daño coclear aislado con indemnidad neural. Esto los convierte en candidatos ideales para implante. (9,10,11)
Hay varios argumentos en contra de incluir, por el momento, el estudio génico como parte de la evaluación inicial ofrecida a los niños con hipoacusia sensorio neural severa a profunda. Uno de ellos se refiere a los falso positivos y falsos negativos, con argumentos éticos de fondo sobre la conducta a seguir con estos resultados, lo que involucra invariablemente el pronóstico, tratamiento y el consejo genético a los padres, pudiendo llevar a estos a conductas radicales. Estos resultados podrían detener el estudio no permitiendo encontrar la verdadera causa si es falso positivo, o un gasto innecesario al continuar el estudio si es falso negativo (5). Los rangos de falso positivo y falso negativo para la detección de la mutación de 35delG se ha calculado en 2,6% y 31% respectivamente. (5)
Tampoco está del todo descartado que la existencia de mutaciones en el gen GJB2 descarte la existencia de otras anormalidades. (1)
Además, es importante que el equipo médico esté preparado para enfrentarse a esta nueva alternativa diagnóstica, tanto en los aspectos técnicos, biológicos, pero sobre todo, respondiendo a la interrogante “qué hacer con la información obtenida”, cuánto sobre ella debe exponerse a los padres, cuál es la nueva perspectiva en el tratamiento para el niño, o si influir o no en cuestiones tan trascendentales como planificar o no un nuevo embarazo. (5)
CONCLUSIÓN
Las series reportadas a nivel mundial como para México hablan de alrededor de 3 casos de hipoacusia por cada 1000 pacientes evaluados. La hipoacusia es una discapacidad frecuente que ha sido subvalorada en las décadas previas, la realidad actual en México es que este tipo de discapacidad se detecta muy tardíamente, ya que normalmente son los padres quienes se dan cuenta de que su hijo presenta este tipo de padecimiento alrededor de los dos años de edad, perdiendo con ello un tiempo irrecuperable para su habilitación. El programa de Tamizaje auditivo surgió por ello como una necesidad, impulsado a través del programa federal de tamiz auditivo e intervención temprana en el año 2007 (PROSESA 2007-2012) (12), y paulatinamente se ha difundido de tal manera que ahora el sector privado de la medicina ha optado por realizar las pruebas de tamizaje auditivo de manera creciente.
De hecho, la literatura señala que por cada 10,000 nacimientos es posible detectar 1 caso de fenilcetonuria, 2.5 de hipotiroidismo, 5 de espina bífida, 10 de fisura labio-palatina, 11 de Síndrome de Down y 30 de problemas auditivos, por lo que no es un problema de salud que desmerezca nuestra atención. (13)
La presente revisión demuestra el hallazgo de 3 casos en 100 pacientes evaluados a lo largo de 1 año en una unidad médica privada, lo que traspolado a las series y casuísticas nacionales resulta elevado, sin embargo habrá que considerar que muchos pacientes acuden a evaluación por una “segunda opinión” cuando ya han sido sometidos a un procedimiento de tamizaje previo, lo que en su defecto actuaría como un filtro previo.
Es verdaderamente importante en la población médica concientizar a otros médicos y a los familiares de los pacientes de la importancia de realizar el tamiz auditivo, realizando siempre el protocolo de estudio que involucra inicialmente las Otoemisiones acústicas, en caso de no pasar la prueba continuar con potenciales Evocados de Tallo cerebral y en caso de determinar hipoacusia continuar con los estudios completos de impedanciometría, audiometrías tonales para la habilitación, de manera inmediata, de los pacientes candidatos a amplificación y en su caso inicio de metodología audio verbal para la socialización.
BIBLIOGRAFÍA
1 LYNNE L, GREINWALD J. Current status of genetics in the evaluation and management of SNHL. Curr Opin Otolaryngol Head Neck Surg 2002, 10: 435-9.
2 KENNA M, WU B-L, COTANCHE D. Connexin 26 in patients with SNHL. Arch Otolaryngol Head Neck Surg 2001; 127: 1037-42.
3 http:/ / www. nidcd. nih. gov/ health/ spanish/hearingaid_span. Asp
4 ERBE C, HARRIS K, RUNGE-SAMUELSON C ET AL. Connexin 26 and connexin 30 mutations in children with nonsyndromic hearing loss. Laryngoscope 2004; 114: 607-11
5 GREINWALD J, HARTNICK C. The evaluation of children with sensorineural hearing loss. Arch Otolaryngol Head Neck Surg 2002; 128: 84-7.
6 CULLEN RD, BUCHMAN C, BROWN C ET AL. Cochlear implantation for children with GJB2- related deafness. Laryngoscope 2004; 114: 1415-9.
7 ERBE C, HARRIS K, RUNGE-SAMUELSON C ET AL. Connexin 26 and connexin 30 mutations in children with nonsyndromic hearing loss. Laryngoscope 2004; 114: 607-
9SMITH R. Mutations screening for deafness. Arch Otolaryngol Head Neck Surg 2001;127: 941-2.
10 VENAIL F, ROUX A, PALLARES-RUIZ N. Nonsyndromic 35 delG mutation of the connexin 26 gene associated with deafness in syndromic children: Two case reports. Laryngoscope 2004; 114: 566-9
11BAUER P, GEERS A, BRENNER C, MOOG J, SMITH R.The effect of GJB2 allele variants on performance after cochlear implantation. Laryngoscope 2003; 113: 2135-40
12 http://conadis.salud.gob.mx/descargas/pdf/tamiz_auditivo_neonatal.pdf
13 American Speech-Language-Hearing Association. (1989, May). Communication based services for infants, toddlers, and their families. A S H A, 3 1, 32-34, 94
*Coordinador Editorial Nacional de la revista “Salud y Cuidados del bebe” de CONAPEME. Adscrito al Centro Médico Londres de Chetumal, Q Roo.
**Presidente del Capítulo Chetumal del Colegio de Pediatría de Quintana Roo. Adscrito al Centro Médico Londres en Chetumal, Q Roo.
Correspondencia: Centro Médico Pediátrico Londres. Av. Retorno Venustiano Carranza No. 532. Colonia Flamboyanes C.P. 77034. Chetumal, Quintana Roo. Tel. 9832087313. Correo electrónico: alfonsodoctor@hotmail.com
