*Dra. Jorgelina Barrios De Tomasi, **Dra. Alejandra Aguirre Crespo, ***Dr. Francisco Aguirre Crespo
RESUMEN
Los ovarios en las mujeres están constituidos por diversas células que en su conjunto funcionan para el desarrollo de una sola célula, llamada óvulo, que eventualmente ovulará una vez al mes. Estas células dentro del ovario se encuentran organizadas en estructuras llamadas folículos ováricos. El folículo ovárico es una compleja unidad funcional y anatómica, cuya función principal es la formación y manutención de un ovocito competente, el cual será liberado mediante la ovulación, esto es, la liberación física del ovocito y las células de la granulosa circundantes. En este proceso de maduración, crecimiento y selección, están implicados una serie de eventos endocrinos, paracrinos y autocrinos entre los tres tipos principales de células foliculares: el ovocito (conocido como óvulo una vez que ha sido liberado del folículo), las células de la granulosa y las células de la teca. Estas células interactúan de una manera sincrónica y se encuentran reguladas por una serie de hormonas y de factores. De estas hormonas y factores dependerá el desarrollo adecuado de un folículo y/o la muerte o atresia de aquellos que no recibieron un estímulo adecuado para alcanzar la ovulación. En la presente revisión se describe cómo estos factores y hormonas desempeñan un rol complejo en el tiempo y en el espacio, siendo el folículo una unidad móvil y no estática, cuyo desarrollo dependerá de la rápida y adecuada comunicación entre los diferentes tipos celulares.
INTRODUCCIÓN
Las gonadotropinas son las hormonas o señales endocrinas que principalmente inducen y promueven estos procesos. Las gonadotropinas son sintetizadas y secretadas por los gonadotrófos en la hipófisis anterior, bajo la influencia de la hormona liberadora de Gonadotropinas (GnRH); la cual es una hormona secretada en el hipotálamo. De esta manera se establece una estrecha relación entre estos tres tejidos, a lo cual se le ha reconocido como el eje hipotálamo-hipófisis-gónada. Las características estructurales de cada señal generada por alguno de los componentes de este eje, determinarán el destino metabólico, la capacidad de unión y activación de sus receptores en la célula blanco y eventualmente la habilidad de inducir una respuesta biológica específica. (1)
Hormona liberadora de Gonadotropinas (GnRH).
La GnRH es un decapéptido producido por células especializadas, predominantemente localizadas en el núcleo arcuato del hipotálamo mediobasal y en el área preóptica de la región anterior del hipotálamo. Los axones de estas neuronas se proyectan hacia varias regiones del cerebro y hacia la circulación portal, donde este decapéptido alcanza los receptores membranales de los gonadotrófos o células secretoras de gonadotropinas en la hipófisis. La activación del receptor para GnRH lleva a la síntesis y secreción de las gonadotropinas en la hipófisis. (1)
Gonadotropinas.
La hormona luteinizante (LH) y la hormona estimulante del folículo (FSH) son producidas por un grupo heterogéneo de células, llamadas gonadotrófos en la hipófisis anterior. Ambas gonadotropinas desempeñan un papel esencial regulando la función gonadal, tanto en humanos como en otras especies. Las células de la granulosa, en el ovario y las células de Sertoli en el testículo son las células blanco para la acción de la FSH. En estas células, la FSH promueve la síntesis de estrógenos y diversos factores no-esteroidogénicos, así como la gametogénesis. Las células blanco para la LH son las células de Leydig en el testículo y diversos tipos celulares en el ovario, en el cual la LH regula las concentraciones locales y sistémicas de los esteroides sexuales. La LH es esencial a su vez para el rompimiento del folículo y la subsiguiente liberación del ovocito, la ovulación.
Estructura de la FSH.
Al igual que la LH, la CG y la TSH, la FSH es una glicoproteína heterodimérica compuesta por las subunidades: α y β, unidas de manera no covalente (2). En una misma especie animal, la síntesis de las subunidades α de estas glicoproteínas está codificada por el mismo gen y por lo tanto presentan una secuencia de aminoácidos casi idéntica (3). Por el contrario, las subunidades β son codificadas por diferentes genes y por lo tanto, le confieren a la hormona especificidad inmunológica y bioquímica. La hormona es funcional y expresa su actividad biológica solamente cuando ambas subunidades se encuentran acopladas.
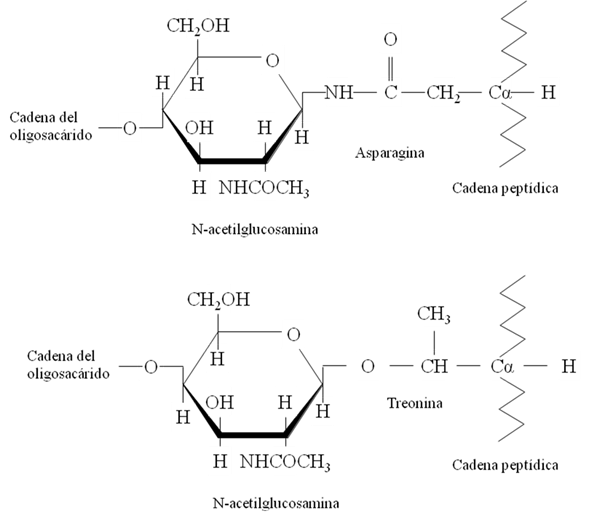
Las gonadotropinas hipofisiarias pertenecen a una familia de glicoproteínas estructuralmente relacionadas. Esta familia está compuesta por la FSH, la LH, la hormona estimulante de tiroides o tirotropina (TSH) y la hormona gonadotropina coriónica (CG), esta última producida en la placenta. Las glicoproteínas son secuencias peptídicas con cadenas laterales de oligosacáridos (azúcares diversos) unidos principalmente en el residuo del aminoácido Asparagina (N) en el caso de FSH; y/o en el residuo de Treonina (T) o Serina (S) en el caso de LH y CG; los cuales se han descrito como enlaces tipo N- u O-glicosídicos respectivamente (1) (Figura 1).
La estructura de la subunidad α consta de 92 a 96 residuos de aminoácidos y tiene dos cadenas de oligosacáridos complejos unidos a Asparagina (N) a través de enlaces N-glicosídicos en las posiciones N52 ó 56 y N78 u 82. La subunidad β presenta 111-112 residuos de aminoácidos y contiene también dos sitios de glicosilación localizados en las posiciones N6,7 ó 13 y N23, 24 ó 30 tanto en la FSH como en la GC (4), mientras que la LH y la TSH presentan un solo sitios de glicosilación unido a Asparagina(Figura 2).


Estructura de los Folículos Ováricos
Hay numerosas formas de clasificar los folículos, pero desde el punto de vista de un folículo que está en continuo cambio tanto en forma como en función, es conveniente clasificar los folículos en primordiales, primarios, preantrales, antrales y preovulatorios. La maduración de los folículos ováricos involucra una serie de estadios secuenciales: iniciación, crecimiento, selección, ovulación y luteinización. Durante la fase folicular del ciclo menstrual se suscitan una serie de eventos que aseguran que un número de folículos maduren y se preparen para la ovulación o la atresia. En el caso del humano, este desarrollo folicular culmina con la maduración de un solo folículo y la ovulación de un solo óvulo. Este proceso está caracterizado por una serie de efectos secuenciales regulados por las diversas hormonas hipofisiarias y gonadales, permitiendo que el folículo destinado a ovular se transforme de un folículo primordial a un folículo primario, preantral, antral y finalmente preovulatorio. (5)
La foliculogénesis se inicia con la fragmentación de los cordones sexuales del ovario embrionario. Una vez iniciada la meiosis en la región medular, los ovocitos mantienen una capa de células epiteliales. Después en la corteza del ovario, los ovocitos se dividen por mitosis dos o tres veces, inician la meiosis y forman una segunda generación de folículos primordiales (6). Los folículos con una capa simple de epitelio cúbico alrededor del ovocito son llamados folículos primordiales (7). El epitelio cúbico se ensancha para formar una capa simple de epitelio columnar que rodea el ovocito. Los folículos primordiales se conocen entonces en folículos primarios, los cuales representan el primer estadio de crecimiento y diferenciación.
El folículo primario consiste en un ovocito detenido en el diploteno de la profase meiótica, rodeado por una capa simple de células de la granulosa. La iniciación del crecimiento folicular es aparentemente independiente de la estimulación de las gonadotropinas; sin embargo, el evento hormonal más importante es el incremento en la concentración plasmática de FSH. Hay algunas células de la teca que se acomodan alrededor de las de la granulosa, pero aún no constituyen una capa bien definida. El ovocito también crece durante este período.
El epitelio columnar simple comienza a dividirse formando un epitelio cúbico estratificado, llegando a formar hasta ocho capas alrededor del ovocito. En este estadio las células epiteliales se reconocen como células de la granulosa y los folículos se identifican como folículos secundarios; tanto las células de la granulosa como las de la teca continúan proliferando, de tal forma que al final del estadio preantral se han desarrollado completamente ambas capas. Una vez que el crecimiento se ha iniciado, el folículo evoluciona al estado preantral, en el cual el ovocito aumenta de tamaño y es rodeado por una membrana constituida por mucopolisacáridos, la zona pelúcida.
Las células de la granulosa comienzan a proliferar, siendo este crecimiento dependiente de las gonadotropinas y está correlacionado con el incremento en la producción de estrógenos. Las células en el folículo preantral sintetizan tres clases de esteroides: estrógenos, andrógenos y progestinas. La aromatización, que es el mecanismo mediante el cual los andrógenos se transforman en estrógenos, es inducida o activada por la FSH (5). La FSH junto con los estrógenos ejercen sinérgicamente una acción mitótica en las células de la granulosa y estimulan su proliferación. Bajo la influencia del estradiol (E2) y la FSH, hay un incremento en la producción del líquido folicular, el cual se acumula progresivamente formando una cavidad, la cavidad antral o antro; a este estadio se le conoce como folículo antral, en el cual los receptores para la LH se encuentran exclusivamente en las células de la teca, mientras que los receptores para la FSH se encuentran en las de la granulosa (5). En respuesta a la LH, la teca es estimulada y produce andrógenos, los cuales son transformados, mediante la aromatización, en estrógenos en las células de la granulosa.
El ovocito junto con las células de la granulosa que lo rodean, que en un principio se encontraba en el centro del folículo, se vuelve excéntrico, formando el cumulus oophorus. Las células de la granulosa que encapsulan al ovocito forman la corona radiada. En este momento se le reconoce al folículo como preovulatorio. El fluido contenido en el antro, el líquido folicular, incrementa su volumen conforme la ovulación se aproxima. El ensanchamiento de la capa de las células de la granulosa está acompañado del desarrollo de una capa externa que deriva del estroma y cubre al folículo. Esta capa constituye la teca, que puede ser dividida en teca interna y teca externa. La teca interna crece rápidamente, sus células adquieren una forma poligonal y tienen un citoplasma vacuolado y un núcleo vesicular. Estas células se encuentran en una red reticular fibrosa que contiene un plexus de capilares sanguíneos y linfáticos. La teca externa contiene fibras de tejido contráctil, formadas por células mioides que desempeñan un rol en la ovulación (7). Mientras que los estrógenos constituyen un estímulo activador en el folículo maduro, hay una retroalimentación negativa a nivel hipotálamo-hipófisiario dando como resultado el retiro del soporte gonadotrópico al resto de los folículos menos desarrollados.
Posteriormente, la FSH induce el desarrollo de receptores de la LH en las células de la granulosa de los folículos antrales, promoviendo la luteinización de la granulosa en el folículo dominante y también la síntesis de progesterona (P), la cual es requerida para inducir la máxima secreción de la FSH en el medio ciclo. La concentración de la LH en el plasma aumenta en la fase folicular tardía estimulando la producción de andrógenos en la teca (5). La concentración máxima de ambas gonadotropinas estimula una serie de sucesos que llevan a la ovulación.
La máxima concentración de LH inicia tanto la reanudación de la meiosis en el ovocito como la luteinización en las células de la granulosa y la producción de prostaglandinas necesarias para la ruptura folicular. La liberación del óvulo está asociada con cambios degenerativos en la colágena de la pared folicular. La LH, la P, o ambas aumentan la actividad de enzimas proteolíticas que degradan la colágena, incrementando la distensión de la pared folicular. En respuesta a la máxima concentración de gonadotropinas, tanto las células de la granulosa como las de la teca sintetizan el activador de plasminógeno.
El aumento en la concentración del activador de plasminógeno lleva al incremento intrafolicular de las concentraciones de plasmina, la cual junto con otras proteasas llevan a la degradación del tejido conectivo de la pared del folículo, permitiendo así el rompimiento y la ovulación. Después de la ruptura del folículo y la liberación del óvulo, las células de la granulosa aumentan de tamaño llevando a la formación del cuerpo lúteo, el cual es el origen principal de las hormonas esteroides sexuales secretadas por el ovario durante la fase postovulatoria o lútea del ciclo menstrual (5).
En resumen, el crecimiento folicular ha sido descrito como un proceso continuo (8). Los folículos comienzan a desarrollarse y no cesan de hacerlo hasta que ovulan o se atrofian. Así, el número de folículos en cualquier estado de crecimiento está determinado por: 1) la proporción de folículos en reposo que inician su crecimiento, 2) la velocidad de crecimiento de los folículos y 3) la proporción de pérdida de folículos por atresia. Si fuera constante el número de folículos que comienzan a crecer, así como la velocidad de crecimiento y la proporción de folículos que se atrofian, el número de folículos de todos los tamaños sería constante. Sin embargo, al variar alguno de estos tres procesos durante el ciclo estral de algunos animales, permite que haya ondas de folículos en crecimiento y, por lo tanto, el número de folículos de un determinado tamaño es diferente durante el ciclo estral. (9)
El desarrollo folicular normalmente termina en atresia; para que se dé la ovulación los folículos deben ser "rescatados" del proceso atrésico. La atresia parece ser el final del crecimiento folicular y los folículos que ovulan son la excepción, no la regla (9). Se ha estimado que a lo largo de la vida reproductiva, un 99.9% de todos los folículos se atrofian y sólo un 0.1% eventualmente ovulan (10,11). Durante la concentración máxima de FSH de un ciclo, se seleccionan los folículos que ovularán durante el subsecuente ciclo; solamente los folículos que fueron rescatados continuarán su crecimiento hasta el final del desarrollo, preparándose para la ovulación del siguiente estro. (9)
Papel de hormonas esteroides durante el desarrollo folicular.
La esteroidogénesis en el ovario se da en una relación estrecha entre las células de la teca y las de las células de la granulosa. Las células de la granulosa producen dos de los esteroides sexuales más importantes: estradiol y progesterona. A pesar de que las células de la granulosa son capaces de producir progesterona de manera independiente, la biosíntesis de estrógenos requiere de la cooperación entre las células de la granulosa y las de la teca. La participación de estos dos tipos celulares y de las gonadotropinas FSH y LH, en la biosíntesis de estrógenos en el ovario, sostiene la teoría llamada dos células-dos gonadotropinas (12) (Figura 3).
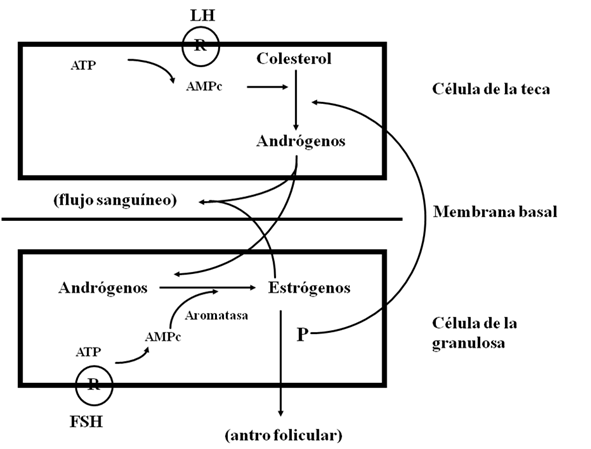
Con base en esta teoría, los andrógenos derivados de la teca, dependientes de la LH son aromatizados por las células de la granulosa bajo el estímulo de la FSH. Hay que recordar que la aromatización es el proceso mediante el cual una molécula orgánica es convertida en un anillo bencénico o aromático. El estradiol y la estrona derivan de la aromatización de los precursores de andrógenos: androstendiona y testosterona, respectivamente (Figura 4), mediante el siguiente mecanismo: Las células intersticiales de la teca son las productoras de los andrógenos (de 19 carbonos), los cuales atraviesan la membrana basal del folículo hasta alcanzar las células de la granulosa donde son aromatizados a estrógenos. Las células de la granulosa son el sitio principal de la aromatización. En cultivos de células de la granulosa, la aromatización es estimulada con FSH y no con LH, siempre y cuando el medio de cultivo contenga el sustrato aromatizable androgénico. Por el contrario las células de la teca no producen cantidades significativas de estrógenos bajo condiciones experimentales. La actividad de la aromatasa en las células de la granulosa se ha estimado que es 700 veces mayor en los folículos preovulatorios que en la teca. Las células de la granulosa son el sitio principal de la síntesis de estrógenos en el folículo dominante preovulatorio. A pesar de que la estrona es producida a partir de la androstendiona, es rápidamente transformada en estradiol con la enzima esteroidogénica 17-β hidroxiesteroide dehidrogenasa (17βHSD). La aromatización involucra la pérdida del grupo metilo del carbono 19 y una eliminación estereoespecífica de los hidrógenos 1-β y 2-β del anillo A del precursor androgénico. Un total de tres hidroxilaciones se requieren por estrógeno formado (Figura 5). (12)
La síntesis esteroidogénica también se lleva a cabo en las mitocondrias a partir de colesterol. En estudios se ha probado la importancia del colesterol (LDL) para la secreción ovárica de progesterona. La función de los estrógenos, además de los múltiples efectos sistémicos, es que ejercen una gran variedad de acciones críticas en el ovario (14). Tanto las células de la granulosa como la teca son sitios de acción de los estrógenos.
En las células de la granulosa, los estrógenos estimulan la división celular, teniendo un efecto antiatrético, inducen a su vez la formación de uniones intercelulares tipo GAP y estimulan la formación del antro folicular y la síntesis de receptores para estrógenos (14). Los estrógenos sinergizan la acción de las gonadotropinas en varios niveles, incluyendo la promoción del crecimiento ovárico, la síntesis de receptores para FSH y LH y aumentan a su vez la actividad de la aromatasa. (14)
La habilidad de los estrógenos para incrementar la actividad de la enzima responsable de su propia formación se suma al incremento exponencial preovulatorio en las concentraciones de estradiol séricas. Esta forma de auto-amplificación pudiera ser importante en el proceso de selección folicular. Por otra parte, los estrógenos bloquean directamente inhibiendo la producción de andrógenos ováricos, bloqueando la conversión de progestinas C21 a andrógenos C19. En resumen, podemos mencionar que los estrógenos: promueven la foliculogénesis, incrementan la expresión de receptores para gonadotropinas, incrementan las uniones tipo GAP mediante un aumento en la síntesis de conexinas en las células de la granulosa, estimulan la esteroidogénesis (testosterona y progesterona en las células de la teca y en las células lúteas respectivamente) e inhiben la apoptosis celular de las células de la granulosa. (14)
La función de los andrógenos en el desarrollo folicular es principalmente que son precursores de los estrógenos y ejercen una variedad de efectos mediados por receptores en las células de la granulosa. Los andrógenos poseen la capacidad de promover la actividad de la aromatasa estimulada por las gonadotropinas. Así, los andrógenos aumentan la actividad de la aromatasa estimulada con FSH, actuando como sustrato y también ejerciendo un efecto parácrino directo, el cual resulta en una regulación positiva de las enzimas esteroidogénicas. Los andrógenos promueven la biosíntesis de progestinas. Por otra parte, las altas concentraciones de andrógenos 5-α reducidos, tales como la dihidrotestosterona actúan como inhibidores competitivos de la actividad de la aromatasa en las células de la granulosa. (12)
En ausencia de gonadotropinas, los andrógenos promueven la atresia folicular. También se ha observado que el aumento en la relación andrógenos a estrógenos está asociado a características morfológicas de la atresia, siendo estos inductores de la apoptosis ovárica, y de la luteinización del folículo (15). La progesterona producida en respuesta al estímulo dado por las gonadotropinas en el medio ciclo es esencial para la ovulación y para la luteinización de los folículos en los primates, teniendo un papel antiproliferativo en las células luteinizadas.
Biosíntesis de esteroides sexuales a partir de colesterol.
La síntesis y el metabolismo de esteroides sexuales, involucran múltiples complejos enzimáticos los cuales son regulados tanto por los sitios intracelulares donde se localizan dichas enzimas, por el tipo celular, así como por múltiples factores y hormonas. Nos enfocaremos básicamente al ovario, teniendo en cuenta que la esteroidogénesis de esteroides sexuales también se lleva a cabo en los testículos y en las glándulas suprarenales.
En primer lugar podemos mencionar que los folículos ováricos son las unidades funcionales del ovario. La función de cada folículo es mantener el soporte necesario para el desarrollo adecuado del ovocito. Las células somáticas del folículo contribuyen en esta función esencial para la reproducción, lo cual involucra una relación estrecha entre los diferentes tipos celulares foliculares. Los productos de secreción más conocidos en el ovario son los esteroides sexuales (16).
La clasificación de los esteroides sexuales con base en su función biológica se divide en tres grupos principales: progestinas, andrógenos y estrógenos, representados por: C21 (pregnano), C19 (androstano) y C18 (estranos) respectivamente (16).
Los esteroides sexuales son producidos a partir de colesterol (C27), el cual proviene de tres posibles fuentes: 1) colesterol preformado, que proviene del flujo sanguíneo, principalmente en forma de lipoproteínas circulantes (LDL lipoproteínas de baja densidad y HDL lipoproteínas de alta densidad), 2) colesterol preformado, almacenado en las células ováricas, tanto como colesterol libre, como constituyente de la membrana celular, y; 3) colesterol sintetizado de novo por las células foliculares (16).
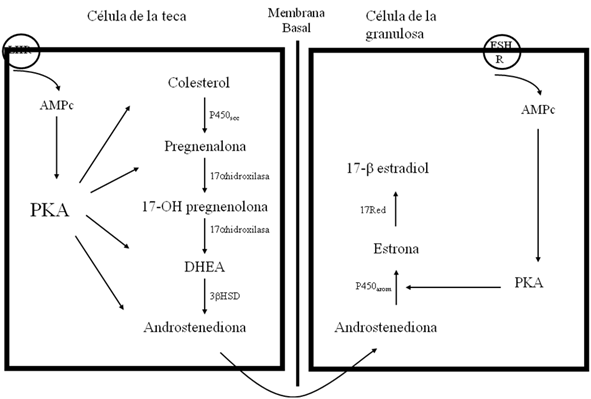
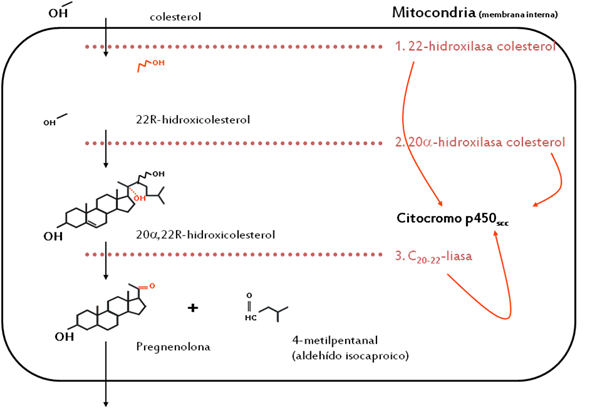
El primer paso en la conversión de colesterol a esteroides, es la ruptura del carbono lateral C-20,22 obteniendo un compuesto C21 conocido como pregnenalona y un fragmento de 6 carbonos: el aldehído isocaproico. El sistema de enzimas que catalizan esta reacción se localiza en la matriz intracelular de la membrana interna de las mitocondrias. (Figura 5)
Es un complejo multienzimático constituído principalmente por la enzima citocromo p-450scc (en inglés side-chain cleavage). La reacción requiere de fosfato del dinucleótido de adenina y de nicotinamida en la forma reducida (NADPH) generado en la mitocondria mediante la oxidación de intermediarios del ciclo de Krebs o de ácidos grasos. Tres moles de NADPH y de oxígeno son requeridos por mol de colesterol. (Figura 5(flechas negras)).
Posteriormente, la pregnenolona es convertida a progesterona por un complejo de enzimas microsomales que incluye a Δ5-3β-hidroxiesteroide deshidrogenasa:Δ5-4-isomerasa, las cuales actúan en conjunto (Figura 5(flechas azules)). Este complejo de enzimas requiere de NAD+ como aceptor de electrones y la reacción es esencialmente irreversible bajo condiciones fisiológicas normales (16), a su vez, la 3β-hidroxiesteroide deshidrogenasa, utiliza los esteroides 5α-reducidos como sustrato en su metabolismo.
La biosíntesis de andrógenos (C19) en el folículo, así como en otros órganos secretores de andrógenos, es un paso limitante que incluye el complejo de enzimas: 17α-hidroxilasa:C-17,20-liasa (Figura 5(flechas rojas)). Este sistema de enzimas es un citocromo p-450 y requiere de NADPH y una molécula de oxígeno. La reacción puede utilizar como sustrato tanto a la pregnenalona como a la progesterona, resultando como productos la dehidroepiandrostendiona o androstendiona respectivamente. Estas dos vías alternativas se les conoce comúnmente como las vías Δ5 (5-ene-3β-hidroxi) (Figura 5, recuadro rosa) o Δ4(4-ene-3-oxo) (Figura 5, recuadro azul) respectivamente. (16)
Los esteroides 17-hidroxi- y 17-oxo- son convertidos mediante una reacción reversible con la enzima 17β-hidroxiesteroide deshidrogenasa presente en los microsomas de varios tejidos esteroidogénicos incluyendo al folículo ovárico (Figura 5(flechas rosas)). Tanto andrógenos como estrógenos son requeridos como sustratos para esta reacción (16). Finalmente, la androstendiona y la testosterona (esteroides 4-ene-C19) son convertidos a estrona y estradiol 17α respectivamente, mediante un complejo de enzimas localizadas en la membrana del retículo endoplásmico liso de varios tipos celulares ováricos. Este complejo enzimático se le conoce como “aromatasa” debido a la estructura aromática de sus productos, es un citocromo p-450 que cataliza una reacción de múltiples pasos que incluyen la eliminación de un grupo metilo en la posición C-19 eliminándose como ácido fórmico y seguido por un rearreglo del anillo A para formar una estructura aromática. La reacción requiere NADPH, y tres moles de O2 son consumidas durante este proceso (Figura 5(flechas verdes)). (16)
Ahora bien, ¿Cuál es el destino de estas células? El destino podrá ser alguno de dos caminos, la ovulación del óvulo y la subsecuente formación del cuerpo lúteo o la muerte celular, llamada atresia.
Las células de los organismos multicelulares se comunican mediante cientos de diferentes tipos de moléculas, como proteínas, péptidos, aminoácidos, nucleótidos, esteroides, retinoides, derivados de ácidos grasos, e incluso algunos gases como el óxido nítrico, entre otras moléculas. Muchas de estas moléculas son secretadas mediante exocitosis. Otras son liberadas por difusión a través de la membrana plasmática, mientras que otras permanecen unidas a la superficie celular e influyen en las células que tienen contacto con ellas.
Sin considerar el tipo de señal, la célula blanco responde mediante una proteína especifica llamada receptor, el cual se une específicamente a la señal e inicia una respuesta celular. Estas moléculas de señalización pueden ser transportadas por largas distancias, o pueden actuar como mediadores locales afectando a las células que se encuentran alrededor. Este proceso se le conoce como evento paracrino, donde las moléculas de señalización no se difunden muy lejos, y son rápidamente tomadas por las células vecinas o por la misma célula que la produjo (evento autocrino).
El otro tipo de señalización especializada es la endocrina. Las células endocrinas secretan moléculas de señalización, las cuales se les conoce como hormonas, y son transportadas por el riego sanguíneo hasta las células blanco. Enfocándonos en el ovario podemos encontrar todos estos tipos de comunicación celular. Como ya mencionamos, la FSH es el principal promotor del desarrollo folicular. Los receptores para FSH se encuentran exclusivamente en la granulosa, por lo que la acción de la FSH en el ovario involucra estas células. La FSH es capaz de incrementar el número de receptores para sí misma en la granulosa, así como la estimulación de la actividad de la aromatasa y el incremento en las uniones tipo GAP.
A pesar de que los estrógenos son los principales promotores de la mitosis en la granulosa, la FSH promueve a su vez la división celular. La LH, tiene un rol principal el mantenimiento del cuerpo lúteo, así como en la inducción de la ruptura folicular durante la ovulación. En primer lugar promueve en las células de la teca la producción de andrógenos, sinergiza junto con la FSH el desarrollo folicular en sus fases tardías promoviendo el crecimiento de los folículos antrales pequeños al estado preovulatorio.
El proceso cíclico de la foliculogénesis ovárica se encuentra marcada por una proliferación dramática que culmina con la diferenciación del folículo maduro. A pesar de que el papel de los esteroides y las gonadotropinas es ampliamente conocido, los diferentes destinos de los folículos han sugerido la existencia de factores intraováricos que modulan el sistema.
El destino de cada folículo, ya sea atresia (muerte celular) u ovulación, está controlado por factores paracrinos y endocrinos. El término reclutamiento se ha utilizado para distinguir dos procesos importantes en el desarrollo folicular relacionados con el destino de cada folículo. Los folículos primordiales inactivos o latentes permanecen reclutados hasta que inician su crecimiento de manera continua, y por otra parte una vez que se incrementa la secreción de FSH en cada ciclo reproductivo se recluta una cohorte de folículos antrales. (17)
Durante el reclutamiento inicial se desconocen los factores intraováricos o factores externos que estimulan a algunos folículos para iniciar el crecimiento, mientras que otros folículos permanecen latentes por meses o años. Sin embargo, este proceso de latencia pudiera estar relacionado con la liberación de un estímulo inhibitorio de origen local o sistémico que mantenga a los folículos en latencia (17).
Por el contrario, el reclutamiento cíclico comienza en la pubertad como un resultado en el incremento de FSH circulante durante cada ciclo reproductivo que rescata a una cohorte de folículos antrales de la atresia. Sólo un número limitado de folículos sobreviven y el resto continúan por la vía de la atresia (vía por default). Después del incremento de las concentraciones de la FSH circulante durante el periodo perimenstrual en la mujer, una cohorte de folículos antrales escapa de la apoptosis debido al factor de sobrevivencia de la FSH. Entre este grupo de folículos hay uno que crece con mayor rapidez (destinado a ovular) y produce grandes cantidades de estrógenos e inhibina, siendo este folículo mucho más sensitivo a la FSH, debido a un aumento en la expresión de receptores de FSH y LH o debido a un incremento en la concentración de factores de crecimiento locales.
Los estrógenos e inhibina suprimen la liberación de FSH en la hipófisis alrededor del medio ciclo, y como consecuencia el resto de los folículos son privados de una estimulación adecuada de FSH, requerida para la supervivencia. Además, el folículo que empieza a crecer a mayor velocidad produce altas concentraciones de factores de crecimiento (entre ellos el factor de crecimiento semejante a insulina (IGF)) que actúan de una manera autócrina y paracrina incrementando la vasculatura y la respuesta a la FSH.
También se ha propuesto que este folículo libera factores que inducen la atresia de los folículos que se encuentran a su alrededor. También se ha estudiado al ovocito en su crecimiento y en el reclutamiento inicial, donde se ha propuesto que los ovocitos que inician primero la meiosis y maduración son los primeros en ovular. La relación entre las células de la granulosa y el ovocito son también un factor esencial para un crecimiento normal del folículo. La supervivencia de los folículos preovulatorios está dada por un mecanismo intrafolicular que incluye factores de sobrevivencia tales como la FSH, LH, hormona de crecimiento, IGF-1, factor de crecimiento epidérmico, TGFα, factor de crecimiento de fibroblastos-2, interleucina-1β, óxido nítrico, entre otros (18). A pesar que las gonadotropinas son los factores más importantes para la sobrevivencia y la ovulación, todos estos factores actúan de manera endocrina, paracrina, autócrina y yuxtácrina para mantener al folículo hasta la ovulación. (17)
Como ya sabemos, el proceso degenerativo por el cual los folículos son eliminados antes de alcanzar la ovulación se le conoce como atresia. El mecanismo de selección de los folículos en la vida reproductiva normal es dado por la exposición a la FSH en un momento determinado del desarrollo.
Los folículos que no tengan este soporte hormonal durante este periodo crítico estarán destinados a la atresia. La apoptosis es un tipo de muerte celular programada. La principal característica que nos indica que la atresia es un proceso apoptótico es que la apoptosis afecta a una sola célula o a un grupo pequeño de células de una manera sincrónica, característica que se da dentro de un folículo y no en los folículos que se encuentran a su alrededor, mientras que otros tipos de muerte celular como la necrosis afectan a toda un área.
Los cambios tempranos de la apoptosis, incluyen la pérdida de las uniones celulares y otras estructuras especializadas de la membrana, al mismo tiempo que el citoplasma y la cromatina nuclear se condensan. (15)
La disminución del volumen del citoplasma está asociada con la pérdida de iones y fluido intracelular, así como la dilatación del retículo endoplásmico y la formación de vesículas que se fusionan con la membrana plasmática, liberando su contenido al espacio extracelular. Conforme el proceso continúa, el núcleo se rompe en varios fragmentos. Posteriormente, la célula se divide en diversos fragmentos que contienen estos restos nucleares con organelos citoplásmicos intactos. A estos fragmentos se les conoce como cuerpos apoptóticos y son fagocitados por las células circundantes o son liberados al lumen adyacente (15). Cabe señalar la presencia de macrófagos en la cavidad antral del folículo, encargadas de fagocitar dichas células.
La apoptosis se asocia con la activación de endonucleasas que degradan el ADN cromosomal en fragmentos de 50 a 300 kilobases y posteriormente en fragmentos más pequeños. La atresia folicular aparentemente es un proceso apoptótico pues está mediada a su vez por la activación de endonucleasas. Una manera de demostrar la presencia de la apoptosis está basada en este fundamento, ya que al realizar una electroforesis en geles de agarosa con el ADN aislado de tejidos en apoptosis, se observa una figura característica similar a una escalera de fragmentos (fragmentos oligonucleosomales), a diferencia de una degradación completa del ADN en otros tipos de muerte celular.
El patrón de fragmentación del ADN que se presenta en células apoptóticas también se encontró en folículos atrésicos pero no en los sanos, demostrando el papel de la apoptosis en la atresia folicular. Las características morfológicas de la atresia han sido descritas como cambios progresivos en todos los tipos celulares del folículo. Una señal temprana de la atresia es la presencia de núcleos picnóticos dentro de las células de la granulosa. Conforme progresa la atresia se va dando el desprendimiento de las células de la granulosa de la membrana basal y aumenta la presencia de restos celulares en la cavidad antral, fragmentación de la lámina basal y se da una reducción masiva en el número de células de la granulosa.
Muchos aspectos relacionados con el mecanismo de acción de las hormonas y moduladores locales aun quedan por investigar, así como el intentar darle un significado fisiológico que ubique a éstas moléculas dentro del gran contexto reproductivo, viendo al ovario como una estructura influenciada por diversos factores tanto físicos, químicos, internos, externos e inclusive temporales, que en su conjunto han llevado a perpetuar la especie de una manera casi perfecta.
BIBLIOGRAFÍA
1 Ulloa-Aguirre A, Timossi C. Biochemical and functional aspects of gonadotropin-releasing hormone and gonadotropins. Reproductive BioMedicine Online., 2000; 1(2):48-62.
2 Pierce JG, Parsons TF. Glycoprotein hormones: structure and function. Ann. Rev. Biochem., 1981; 50:465-495.
3 Fiddes JC, Talmadge K. Structure, expression and evolution of genes for the human glycoprotein hormones. Recent Prog. Horm. Res., 1984; 40:43-78.
4 Smith GM, Bishop LA, DeKroon R, Wright G, Cerpa-Poljak A, Schofield PR. Purification and characterization of recombinant human FSH. In: Hunzicker-Dunn M, Schwartz NB (Eds) Follicle stimulating hormone. Regulation of secretion and molecular mechanisms of action. Serono Symposia USA, Proceedings. Springer-Verlag, New York, 1992; pp 335-338.
5 Speroff L, Glass RH, Kase NG. Clinical Gynecologic Endocrinology and Infertility. Fourth Edition. Williams & Wilkins, Maryland, USA., 1989; 668 pp.
6 Merchant-Larios H. Germ and somatic cell interactions during gonadal morphogenesis. In: Van Blerkom J, and Motta PM, (eds). Ultrastructure of reproduction. The Netherlands, 1984; 19-30.
7 Freeman ME. The neuroendocrine control of the ovarian cycle of the rat. In: Knobil E, Neil JD. (Eds). The physiology of reproduction. Vol. 1. 2nd de. Raven Press, Ltd., New York, 1994; pp 613-658.
8 Peters H, Byskov AG, Himelstein-Braw R, Faber M. Follicular growth: The basic event in the mouse and human ovary. J. Reprod. Fert., 1975; 45:559-566.
9 Hirschfield AN, Midgley AR Jr. Morphometric analysis of follicular development in the rat. Biol. Reprod., 1978; 19:597-605.
10 Ingram DL. Atresia. En: The Ovary. S Zuckerman de. Academic Press, New York., 1962; pp. 247-273.
11 Schwartz NB. The role of FSH and LH and their antibodies on follicle growth and on ovulation Biol Reprod., 1974; 10:236-272.
12 Yen SSC, Jaffe RB, Barbieri RL; Reproductive Endocrinology. Physiology, Pathophysiology, and Clinical Management. Fourth Edition. W.B. Saunders Company, USA, 1999.
13 Adashi EY: The ovarian follicle: Life cycle of a pelvic clock. En: Reproductive endocrinology, Surgery, and Technology. Vol 1. Lippincott-Raven Publishers, 211-234, 1996.
14 Rosenfeld CS, Wagner JS, Roberts MR, Lubahn DB: Intraovarian actions of oestrogen. Reproduction. 2001; 122:215-226.
15 Hsueh AJW, Billig H, Tsafriri A: Ovarian follicle atresia: a hormonally controlled apoptotic process. Endocr Rev. 1994; 15(6):707-24.
16 Knobil E, Neil JD, The physiology of reproduction. Raven Press. 1988.
17 McGee EA, Hsueh AJ: Initial and cyclic recruitment of ovarian follicles. Endocr Rev. 2000; 21(2):200-214.
1 McCann SM, Mastronardi C, Walczewska A, Karanth S, Rettori V, Yu WH: The role of nitric oxide in reproduction. Braz J Med Biol Res. 1999; Nov;32(11):1367-79.
*Profesor Investigador de la División Ciencias de la Salud. Universidad de Quintana Roo.
**Profesor Investigador de la División Ciencias de la Salud. Universidad de Quintana Roo.
***Profesor Investigador de la División Ciencias de la Salud. Universidad de Quintana Roo.
Correspondencia: Universidad de Quintana Roo. División de Ciencias de la Salud. Avenida Erick Paolo Domínguez casi esquina Av. 4 de Marzo. Colonia Magisterial. C.P. 77030, Chetumal, Quintana Roo. Teléfono: (044) 9831072076 Correo electrónico: jorgelina@uqroo.mx
